GIS IBiSA, JUIN 2024
En l’espace d’une décennie, cette méthode d’observation ultraprécise n’a eu de cesse d’être perfectionnée. Ses améliorations concernent tout autant la résolution des instruments que les techniques d’acquisition d’image et de préparation d’échantillon. Elles bénéficient très largement aux sciences du vivant, et en particulier à la biologie structurale.
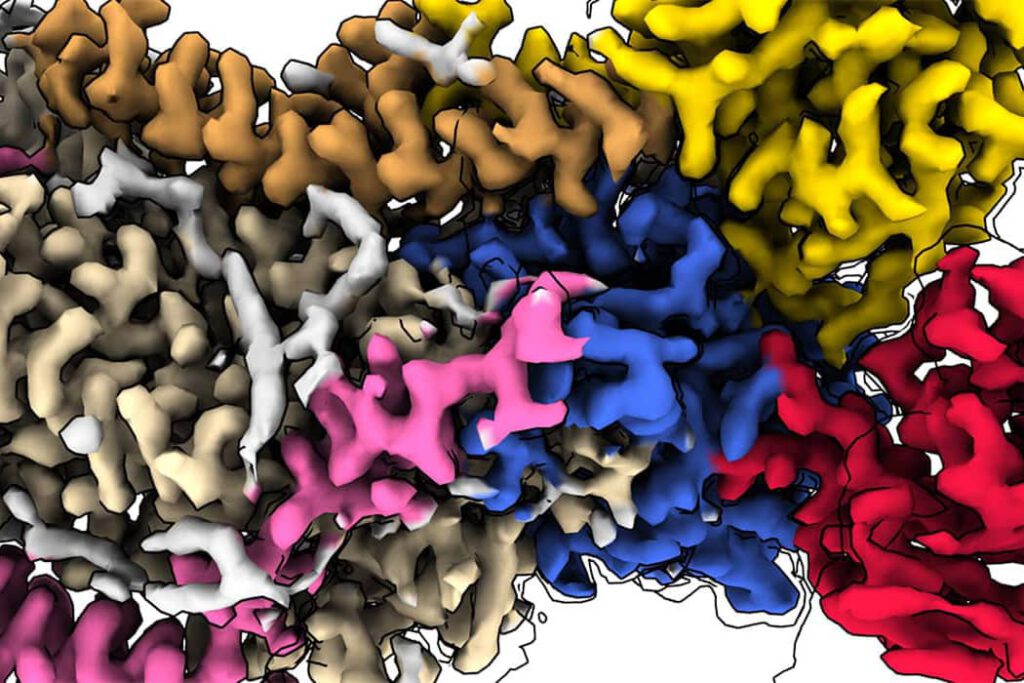
En mars 2020, le monde prend conscience qu’il est aux prises avec une pandémie provoquée par l’émergence d’un nouveau virus, le SARS-CoV-2. Fort heureusement, la structure de la protéine spike, la fameuse clé moléculaire qui aide le virus à pénétrer dans nos cellules, n’est déjà plus un secret pour la communauté scientifique. Une prouesse que l’on doit aux récentes évolutions de la cryo-microscopie électronique.
La technique de microscopie électronique utilise un faisceau d’électrons pour capter une image très agrandie d’un échantillon. Mais bien qu’elle existe depuis près d’un siècle, son application à l’étude à haute résolution de la machinerie moléculaire des cellules et des virus remonte seulement au début des années 2000. « Le problème, c’est que les échantillons biologiques ont la particularité d’être à la fois riches en eau et constitués d’atomes légers : ils peuvent facilement être altérés par le faisceau d’électrons des microscopes », explique Stéphane Bressanelli, directeur de recherche CNRS à l’Institut de biologie intégrative de la cellule (I2BC). Pour pallier à cet inconvénient de taille, la stratégie consiste à congeler le matériel biologique en le plongeant dans de l’éthane liquide à – 190°C. Ainsi vitrifié, l’échantillon placé dans le microscope à froid demeure à l’état solide, avec une conservation intacte des constituants cellulaires, organites, protéines ou ADN à analyser. Ce principe est précisément celui de la cryo-microscopie électronique (cryo-EM), une variante de la technique particulièrement adaptée à l’observation des structures biologiques.
L’avantage des outils de calcul
Parallèlement au développement de la méthode, les dispositifs de prise de vue ont eux aussi été nettement améliorés. En quelques années, les instruments ont été équipés de caméras capables de réaliser jusqu’à plusieurs centaines de prises de vue par seconde. Avec le pouvoir de résolution des cryo-microscopes qui avoisine 1 ångström, soit le diamètre de certains atomes, ces caméras sont en mesure de reconstituer l’architecture tridimensionnelle de grandes protéines comme les enzymes polymérases, voire de molécules plus petites comme les hémoglobines. « Elles enregistrent des dizaines ou des centaines de milliers d’images en deux dimensions de la molécule cible observée sous tous ses angles », détaille Stéphane Bressanelli. « La puissance et la performance des outils de calcul informatique et des logiciels de reconstruction permettent ensuite d’extraire et de compiler ces images pour générer un modèle 3D de la structure biologique à l’échelle atomique. »
La cryo-microscopie électronique est généralement moins précise que la cristallographie aux rayons X, encore privilégiée pour l’analyse des protéines de très petite taille. Elle se révèle en revanche bien plus rapide et versatile. Avec cette méthode, la structure atomique d’un complexe macromoléculaire purifié en faible quantité peut être établie en quelques jours, contre plusieurs mois avec la cristallographie aux rayons X, tant la préparation de l’échantillon – purification puis cristallisation – peut se révéler fastidieuse.
Observer les molécules en plein cœur de la cellule
Les dernières générations de cryo-microscopes électroniques sont dotées de caméras à très haute résolution, mais également de modules de tomographie, à l’image du Glacios 2 qui équipera très prochainement la composante Cryo-EM de la plateforme BioStruct@UPSAY. Grâce à ce type d’instruments dernier cri, il sera bientôt envisageable d’observer les molécules directement à l’intérieur de la cellule. La cryo-tomographie électronique reste cependant une forme d’analyse encore balbutiante, en raison du savoir-faire spécifique requis, notamment pour la préparation des échantillons. Il faut en effet parvenir à découper, dans une cellule vivante cryogénisée, une fine lamelle d’environ 200 nanomètres d’épaisseur comprenant la région à investiguer. Des instruments spécifiques, utilisant là encore un faisceau d’électrons, sont maintenant de plus en plus employés pour raboter la surface de la cellule, jusqu’à atteindre la zone à étudier. « À court terme, cette méthode laisse entrevoir la possibilité de décrire les interactions moléculaires qui se déroulent au cœur même d’une cellule infectée », illustre le chercheur.
Une autre approche tout aussi novatrice se démocratise peu à peu. Baptisée cryo-microscopie corrélative, elle consiste d’abord à identifier une protéine ou un évènement d’intérêt, comme l’entrée d’un virus dans une cellule, à l’aide d’un microscope optique et de marquages fluorescents. À l’issue de cette étape, le même échantillon est imagé par cryo-microscopie électronique afin de visualiser les structures biologiques dans leur contexte cellulaire. La principale difficulté de cette approche réside elle aussi dans la préparation de l’échantillon cryogénisé, celui-ci devant supporter des manipulations successives sur différents instruments, sans être altéré. « Globalement, la microscopie électronique appliquée à la recherche en biologie structurale a déjà atteint un certain niveau de maturité en termes de résolution », résume Stéphane Bressanelli. « Les marges de progression se situent désormais du côté de la sélection et du conditionnement des échantillons à analyser ».
