CNRS LE JOURNAL, NOVEMBRE 2018
VIH, obésité, Parkinson… autant de maladies qui pourraient être soignées grâce à des glucides complexes. En s’inspirant de ces sucres, présents à la surface de nos cellules, plusieurs équipes de recherche élaborent différentes stratégies. Démonstration avec six applications.
Souvent pointé du doigt pour ses méfaits, le sucre inspire aussi de nouvelles voies thérapeutiques. Les spécialistes des glycosciences s’intéressent ainsi à la structure spatiale et aux propriétés chimiques des longues chaînes de glucides présentes à la surface de nos cellules. « Ces sucres complexes sont impliqués dans la plupart des maladies chroniques et infectieuses, explique Anne Imberty, directrice du Centre de recherche sur les macromolécules végétales (Cermav) du CNRS, à Grenoble. Ils sont en effet reconnus par des récepteurs protéiques qui se trouvent sur les bactéries et les virus mais aussi sur les cellules du système immunitaire. »
Pour combattre une infection, les chercheurs ont donc eu l’idée de façonner des molécules « leurres » qui miment l’action de ces glucides complexes tout en ayant un pouvoir d’attraction démultiplié. Au lieu de se fixer sur les cellules de la paroi intestinale ou pulmonaire pour y déclencher une réaction infectieuse, les agents pathogènes vont se lier à ces molécules « leurres ». « Ces molécules “antiadhésives” permettent de neutraliser un micro-organisme pathogène, d’atténuer non seulement l’infection mais aussi l’inflammation », explique Julie Bouckaert chercheuse au sein de l’Unité de glycobiologie structurale et fonctionnelle ¹.
Les sucres complexes subissent par ailleurs une succession de réactions enzymatiques destinées à les assembler et à les associer à d’autres molécules comme les lipides ou les protéines : c’est la glycosylation. Biochimiste dans le même laboratoire que Julie Bouckaert, Anne Harduin-Lepers étudie les étapes ultimes de ce processus dont le dérèglement est à l’origine de cancers épithéliaux comme ceux du sein et du côlon. « Si nous parvenons un jour à identifier les mécanismes moléculaires qui sous-tendent cette perturbation, nous pourrons développer de nouvelles voies thérapeutiques agissant directement sur les enzymes de la glycosylation », espère la chercheuse. En attendant, voici six applications en cours de développement.
1. Des groupes sanguins mieux identifiés
Les sucres complexes qui tapissent nos cellules jouent un rôle majeur dans nos interactions avec les protéines portées par les virus, les bactéries et les cellules de notre système immunitaire. On sait aussi qu’une maladie bactérienne comme le choléra affecte davantage les individus porteurs du groupe sanguin O. Partant de ces constats, des équipes de Grenoble et de Graz (en Autriche) essaient de développer une méthode de détection des groupes sanguins reposant sur les récepteurs bactériens.
Les chercheurs ont détourné la machinerie cellulaire d’une bactérie pour qu’elle fabrique des récepteurs protéiques disposant d’atomes de fluor en des points précis de leur squelette moléculaire. « Ainsi modifiés, les récepteurs protéiques ont témoigné d’une affinité plus forte pour les sucres portés par les globules rouges du groupe sanguin A », résume Anne Imberty, biochimiste au CNRS et directrice du Cermav, à Grenoble. Le fait de pouvoir déplacer à loisir les atomes de fluor à la surface de la protéine offre la possibilité de mettre au point des biomarqueurs spécifiques à chaque groupe sanguin. Le but : rendre plus fiables les tests destinés à limiter les risques de rejet associés aux transfusions sanguines.
2. La thérapie génique dans des capsules
Chaînes cycliques de glucose en forme d’abat-jour, les cyclodextrines ont la capacité d’encapsuler des molécules, comme dans une cage. À partir de ces « cages », une équipe réunissant des chercheurs issus de trois laboratoires français ² a élaboré une structure qui peut transporter des molécules biologiques, et, en particulier, des fragments d’ADN. « Grâce à des modifications chimiques sur la cyclodextrine, nous avons permis que ces molécules s’emboîtent, explique Matthieu Sollogoub, enseignant-chercheur à l’Institut parisien de chimie moléculaire ³. Nous avons ensuite créé une succession de points d’ancrage (chargés positivement) sur ces emboîtements, ce qui permet à un brin d’ADN (chargé négativement) de s’y arrimer. »
Ces structures présentent aussi l’avantage d’être réversibles. Une fois la molécule d’intérêt acheminée dans le cytoplasme d’une cellule, la colonne de cyclodextrines se dégrade spontanément libérant l’ADN et évitant ainsi tout risque de toxicité pour l’organisme. Ces caractéristiques laissent notamment entrevoir la possibilité d’utiliser les cyclodextrines comme vecteurs de gènes dans le cadre de la thérapie génique.
3. La fibre intestinale des prébiotiques
Grâce à un procédé novateur d’extraction des hémicelluloses, une équipe du Laboratoire génie des procédés papetiers (LGP2) 4, du Cermav et du laboratoire Techniques de l’ingénierie médicale et de la complexité 5, a isolé un mélange d’oligosaccharides au fort potentiel prébiotique.
Après l’avoir testé sur des bactéries de notre système digestif, ce mélange a été administré à des souris. À l’aide d’analyses ADN, les chercheurs ont démontré que son absorption par les rongeurs avait favorisé la croissance des « bonnes » bactéries de leur système digestif. « Les indicateurs moléculaires de l’inflammation atteignaient des niveaux de concentration moins élevés que chez des souris n’ayant pas reçu de prébiotiques », précise Christine Chirat, professeure en chimie du bois au LGP2 et coordinatrice de ces travaux.
Les bénéfices de ce mélange de sucres complexes, 100 % naturel, augurent de sa prochaine commercialisation comme complément alimentaire visant à corriger une carence en fibres. Reste à en caractériser la totalité des molécules qui le composent. Des applications médicales destinées à lutter contre l’obésité ou les maladies inflammatoires chroniques de l’intestin pourront ensuite être envisagées.
4. Un gel réparateur du tissu cérébral
Si l’acide hyaluronique est surtout connu pour sa propension à gommer les rides, ses longues chaînes de sucres veillent aussi au bon développement de nos cellules, notamment dans le cerveau. En le combinant à un oligomère d’acides aminés (fragments de protéines courts), Rachel Auzély-Velty et son équipe ont conçu un gel susceptible de contrôler la régénération du tissu cérébral. « En injectant notre gel dans le cerveau de rats, nous avons déjà pu démontrer sa biocompatibilité tout en constatant par IRM que celui-ci restait parfaitement localisé dans la zone ciblée par l’injection », commente l’enseignante-chercheuse au Cermav.
En associant leur gel à des cellules souches neurales, les chercheurs envisagent à présent de reconstruire des réseaux de neurones fonctionnels au niveau de zones cérébrales lésées à la suite d’un AVC. Cette stratégie pourrait aussi un jour compenser la destruction de cellules nerveuses liée à la maladie de Parkinson.
5. Le VIH stoppé par un mime
Dans la lutte contre le virus du Sida, les premières molécules validées inhibaient la réplication du VIH au sein de cellules déjà infectées. Bloquer le virus avant son entrée dans ses cellules cibles est une piste plus récente 6. Le mécanisme d’entrée du VIH met en jeu de multiples cibles thérapeutiques potentielles, souvent étudiées indépendamment les unes des autres.
En rupture avec ces approches, un consortium français 7 a conçu une stratégie originale visant à bloquer simultanément l’interaction du VIH avec trois acteurs majeurs de son entrée : le récepteur CD4, les corécepteurs CCR5 et CXCR4, et un polysaccharide linéaire et sulfaté, l’héparane sulfate. Pour cela les chercheur ont conçu et synthétisé la molécule CD4-HS : un mime fonctionnel du récepteur CD4 lié à un dodécamère synthétique d’héparane sulfate.
« Nous avons d’abord vérifié in vitro que CD4-HS bloquait les sites de reconnaissance du VIH prévus, lui interdisait l’accès aux cellules et possédait une remarquable activité antivirale, explique David Bonnaffé, membre du consortium et enseignant-chercheur à l’Institut de chimie moléculaire et des matériaux d’Orsay 8. Puis une optimisation moléculaire nous a permis de sélectionner un composé encore plus actif pour une étude in vivo chez le macaque, qui a mis en évidence la capacité de notre composé à empêcher une contamination via les muqueuses vaginales. » Cette efficacité thérapeutique chez l’animal permet d’envisager d’utiliser cette molécule à des fins préventives et a confirmé son potentiel dans des traitements curatifs.
6. Un spray contre les infections pulmonaires
Deux chimistes du CNRS ont conçu des molécules « leurres » spécialement destinées aux micro-organismes pathogènes responsables des infections pulmonaires. « Elles sont constituées d’une charpente chimique sur laquelle se greffent plusieurs sucres de synthèse. Ceux-ci imitent les glucides complexes présents à la surface des cellules qui tapissent la paroi des poumons », détaille Sébastien Gouin, chercheur au laboratoire Chimie et interdisciplinarité : synthèse, analyse, modélisation 9.
Introduits sous forme de spray dans les voies respiratoires, ces composés s’arriment solidement aux récepteurs protéiques des agents pathogènes, les empêchant de se fixer à la paroi pulmonaire. « En réduisant presque à néant le pouvoir de virulence de ces micro-organismes, cette stratégie antiadhésive offre l’opportunité de diminuer significativement le risque d’infection chez les personnes immunodéprimées comme les patients placés en soins intensifs ou les malades de la mucoviscidose », commente Sébastien Vidal de l’Institut de chimie et biochimie moléculaires et supramoléculaires 10.
L’innocuité de ces molécules antiadhésives a été démontrée chez la souris, mais d’autres tests doivent être réalisés chez l’animal. S’ils sont concluants, les premiers essais cliniques sur l’homme pourraient débuter d’ici à trois ou cinq ans.
Notes :
- Unité CNRS/Université de Lille.
- Institut parisien de chimie moléculaire (CNRS/Sorbonne université), Institut Pierre-Louis d’épidémiologie et de santé publique, Laboratoire processus d’activation sélectif par transfert d’énergie uni-électronique ou radiatif (CNRS/ENS Paris/Sorbonne Université).
- Unité CNRS/Sorbonne Université.
- Unité CNRS/Grenoble INP Pagora.
- Unité CNRS/Grenoble INP/Université Grenoble Alpes.
- Validée par la commercialisation des antirétroviraux Enfuvirtide et Maraviroc.
- Des chercheurs du CEA, du CNRS, de l’Institut Pasteur et des universités Joseph-Fourier et Paris-Sud.
- Unité CNRS/Université Paris-Sud.
- Unité CNRS/Université de Nantes.
- Unité CNRS/Université de Lyon/Insa Lyon/École supérieure de chimie, physique, électronique de Lyon.
Photo 1 : Vues au microscope de grains d’amidon (à gauche et à droite), de fibres de cellulose régénérée (au centre en haut) et de bois (au centre en bas). © CERMAV
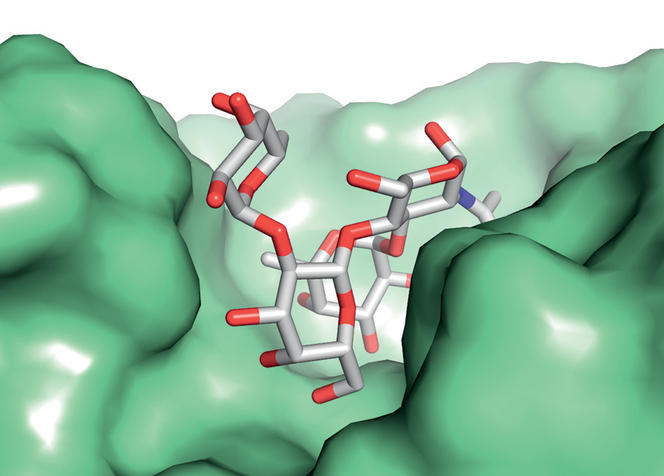
Photo 2 : Molécule de sucre dans le site de reconnaissance d’un anticorps humain (en vert). Les sucres des cellules sanguines jouent un rôle majeur au niveau immunitaire. © A. IMBERTY/CERMAV
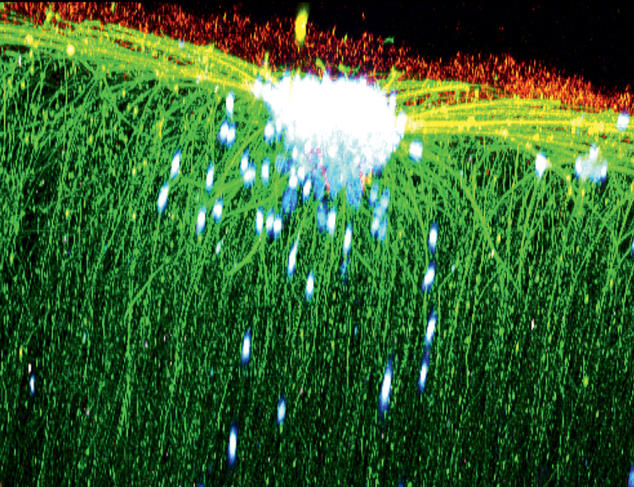
Photo 3 : Développement de neurites (prolongements de neurones) in vitro dans un gel ensemencé par des cellules souches neurales. Vue en microscopie biphotonique. © L.HAMARD, B.VAN DER SANDEN/INSERM/TIMC-IMAG
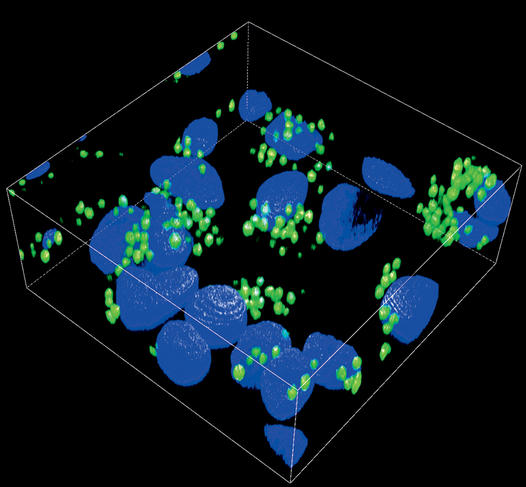
Photo 4 : Adhésion de spores d’un agent infectieux (Aspergillus fumigatus, en vert) sur des cellules pulmonaires (en bleu). Vue en microscopie de fluorescence. © P. LE PAPE/LABORATOIRE ICIMED